EMPLOIS
Emplois vacants
Au laboratoire U1121, trois sujets de thèse prioritaires sont à pourvoir au sein de l’Ecole Doctorale 182 « Physique-Chimie-Physique » :
1. Développement de systèmes protéiques auto-assemblés pour la délivrance de molécules anti-inflammatoires : application à la problématique de l’arthrose / HEURTAULT Béatrice
2. Hydrogels based on peptides and polysaccharides to manage chronic wounds / LAVALLE Philippe
3. Mécanotransduction valvulaire par la sérotonine et le récepteur 5-HT2B dans un environnement 2D statiques et 3D dynamiques / VAUTIER Dominique & MONASSIER Laurent
Emplois pourvus
Emplois pourvus

POLYMER NANOPARTICULES LOADED WITH Au NANOCLUSTERS FOR NIR-II BIOIMAGING
Luminescence and fluorescence have the potential to achieve fast and sensitive biosensing and bioimaging with resolutions down to single biomolecules, but they require powerful and specific probes. Luminescent polymer nanoparticles (NPs) are rapidly gaining importance as bright probes.[1,2] At the same time, the strong autofluorescence, absorption, and scattering of cells and tissues still strongly limit the achievable resolutions at depths beyond the µm-scale.[3] A solution to overcome these problems is shifting the observation wavelengths to the second near infrared window (NIR-II) between 1000 and 1700 nm. However, bright contrast agents emitting in this wavelength region remain scarce.
In the present project, we will design a new type of luminescent nanohybrid by encapsulating high amounts of NIR-II emitting gold nanoclusters in polymer NPs.[4–6] Particle formulation through nanoprecipitation and polymer design will be used to assemble brightly luminescent loaded NPs. Particle properties as size, surface chemistry, and fluorescence will be optimized using dynamic light scattering, electron microscopy and fluorescence spectroscopy. The resulting new class of nanohybrid based contrast agents will be evaluated for in depth bioimaging at the single particle level in the context of fibrosis.
We are looking for a motivated master student who is interested in working at the interface of polymer science, material science, and bioimaging. The proposed M2 internship is part of an ambitious ANR project including specialists in material and polymer science, photophysics and biology. The internship will take place in the Laboratory of Biomatériaux et Bioingénierie at the CRBS, Strasbourg, under the supervision of Andreas Reisch. Our lab offers a strongly interdisciplinary and international environment with researchers from biology, chemistry, and physics. It features up-to date chemical synthesis facilities and equipment for material characterization, fluorescence imaging, and cell culture.
References:
1. X. Han, K. Xu, O. Taratula, K. Farsad, Nanoscale 2019, 11, 799.
2. A. H. Ashoka, I. O. Aparin, A. Reisch, A. S. Klymchenko, Chem. Soc. Rev. 2023, doi:10.1039/D2CS00464J.
3. S. Yoon et al., Nat Rev Phys 2020, 2, 141.
4. X. L. Guével et al., Chem. Commun. 2022, 58, 2967.
5. L. Haye et al., Advanced Optical Materials 2023, 11, 2201474.
6. A. A. Simon et al., Advanced Science 2024, 11, 2309267.
To apply, please contact Andreas Reisch (reisch@unistra.fr) joining a brief CV, recent grades, and a motivation letter.
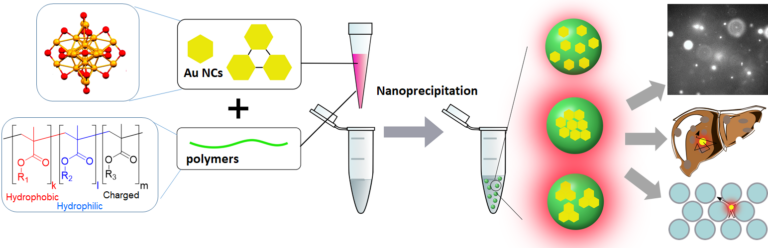
Scheme of Assembly of luminescent nanoparticles and their use in single particle

OFFRE DE THESE : COMPLEXES CARBENES DE PLATINE/OR/ARGENT POUR TUER LES CELLULES SOUCHES CANCEREUSES DU GLIOBLASTOMES. SYNTHESE, ETUDES IN VITRO et IN VIVO
DIRECTEURS DE THESE : SYLVIE FOURNEL et ANTOINE KICHLER
INSERM / CNRS / UNIVERSITE DE STRASBOURG, UMR _S 1121 – EMR CNRS 7003, BIOMATERIAUX ET BIOINGENIERIE, CRBS 1 RUE BOECKEL, 67000 STRASBOURG
E-MAIL : s.fournel@unistra.fr et kichler@unistra.fr
Le glioblastome (GBM) est la tumeur cérébrale primaire la plus répandue. Des données expérimentales et cliniques indiquent que des populations rares de cellules cancéreuses, appelées cellules souches cancéreuses (CSC), jouent un rôle important dans l’absence de réponse du GBM à la thérapie. Les CSC sont définis par leur capacité à s’auto-renouveler et à donner naissance à toutes les lignées retrouvées dans le gliome et sont relativement résistants à la chimio et à la radiothérapie. Par conséquent, le ciblage spécifique des CSC est crucial pour un traitement efficace du GBM. Le(s) mécanisme(s) cellulaire(s) responsable(s) de la résistance aux thérapies des CSC restent largement inconnus. Cependant, les mitochondries seraient impliquées dans cette résistance, car elles contrôlent i) le métabolisme énergétique et ii) la susceptibilité à la mort cellulaire par apoptose. Il a été démontré que plusieurs classes d’antibiotiques approuvés par la FDA, qui inhibent la biogenèse mitochondriale, pourraient être utilisés pour éradiquer les CSC. Ainsi, le développement de nouveaux médicaments qui perturbent spécifiquement les mitochondries ou induisent une apoptose dépendante des mitochondries dans les CSC apparaît comme une stratégie très prometteuse pour la thérapie du GBM.
En collaboration avec l’équipe du Dr. S. Bellemin-Laponnaz (IPCMS, Strasbourg), nous avons récemment développé des molécules innovantes à base de platine, stabilisées par des carbènes N-hétérocycliques NHC-Pt dont la solubilité et la biodisponibilité sont augmentées par leur conjugaison avec le polyéthylèneimine (PEI). Le PEI-NHC-Pt présente une forte cytotoxicité vis-à-vis d’une grande variété de cellules tumorales humaines et murines in vitro. De manière intéressante nous avons vu que l’oxaliplatine et le cisplatine étaient essentiellement localisés dans le noyau cellulaire alors que notre PEI-NHC-Pt est quant à lui en partie localisé dans les mitochondries et induit une apoptose dépendante de celles-ci. Ces caractéristiques rendent le PEI-NHC-Pt particulièrement intéressant pour cibler les CSC. Et, de fait, des résultats récents de l’équipe montre une cytotoxicité importante du PEI-NHC-Pt sur plusieurs lignées de cellules souches de glioblastome. Ces résultats prometteurs nous encouragent à aller plus loin.
Le projet vise à développer plusieurs stratégies afin d’améliorer l’efficacité de ces composés. Pour atteindre cet objectif, nous allons :
1- Cibler ces cellules en nous concentrant sur un marqueur des CSC -le CD44- qui est le récepteur de l’acide hyaluronique (HA), un polysaccharide linéaire chargé constitué de motifs répétitifs d’acide glucuronique et de N-acétyl-D-glucosamine. La stratégie de ciblage comprendra le revêtement non covalent (par interactions électrostatiques) du PEI-NHC-Pt par des HA de différents poids moléculaire,
2- Utiliser des PEI de faible masse pour réduire la toxicité intrinsèque du polymère ou encore utiliser des polymères différents pour générer de nouveaux complexes polymères-NHC-Pt,
3- Tester l’efficacité d’autres métaux que le platine et notamment l’or (Au) et l’argent (Ag).
Après synthèse, les divers complexes métalliques seront testés sur différents types de cellules tumorales humaines et CSC à l’aide de tests de viabilité simples. Les complexes les plus intéressants seront analysés plus précisément pour comprendre comment ils induisent la mort cellulaire (apoptose, nécrose, implication des caspases…) et comment ils entrent dans les cellules en utilisant des complexes fluorescents. Les effets des complexes sur les mitochondries seront alors étudiés en détail (analyse par cytométrie en flux de l’activité respiratoire des mitochondries, de l’intégrité des mitochondries ou de la production de radicaux libres de l’oxygène). Les marqueurs de différenciation de cellules souches seront également étudiés. Finalement, les meilleures molécules seront testées in vivo dans un modèle tumoral murin.

THESIS OFFER : SMART ANTIMICROBIAL HYDROGELS BASED ON SELF-ASSEMBLIES OF PEPTIDES
DIRECTEUR DE THESE : PHILIPPE LAVALLE
INSERM / CNRS / UNIVERSITE DE STRASBOURG, UMR _S 1121 – EMR CNRS 7003, BIOMATERIAUX ET BIOINGENIERIE, CRBS 1 RUE BOECKEL, 67000 STRASBOURG
TEL : 03 68 85 30 61 ; E-MAIL : philippe.lavalle@inserm.fr
The resurgence of antibiotic-resistant bacterial strains is becoming a major problem, especially in cases of nosocomial infections. More than 50% of these nosocomial infections are linked to medical devices such as implants, catheters, catheters, etc. Thus, there is an urgent need to develop new alternative strategies to conventional antibiotics and innovative antimicrobial materials. Moreover, chronic wounds, and more specifically diabetic wounds, are prone to infections and lead to major complications.
Our recent work on polypeptide-based coatings, including polyarginine (1-4), has shown the effectiveness of these molecules. However, at present, there is no specificity against only pathogenic bacteria and fungi. In this project, an entirely new family of smart antibacterial hydrogels. These hydrogels will provide antimicrobial activity exclusively in the presence of one specific microbial strains. The activity will based on the local production of antimicrobial peptides and in addition to their self-asembly ability forming locally a supramolecular network arounf the bacteria or fungi (5). It will result from the interaction of the peptides with the bacterial membrane and not to their action onto the bacterial metabolism as do conventional antibiotics. This will prevent bacterial resistance. Moreover, the peptide self-assembly will isolate the bacteria one from each other and thus will prevent biofilm formation and will facilitate their erradication. The specificity of the action will be obtained by tranforming precursor peptides into active self-assembling peptides through stimuli produce by a specific bacteria. The advantage of this specific activation of the targeted pathogens will be the preservation of the microbiota involved in many biological function. These innovative hydrogels will be a local alternative to systemic antibiotherapy. They will be used in many applications and could be incorporated in bandages or directly brought in contact with chronic wounds in a injectable form.
This work will be performed at the Biomaterials and Bioengineering lab (https://www.biomaterials-bioengineering.com) in close collaboration with clinicians and medical device companies.
1. Lebaudy E., Petit L., Nominé Y., Heurtault B., Ben Hadj Kaddour I., Senger B., Rodon Fores J., Vrana N. E., Barbault F., Lavalle P., “The antibacterial properties of branched peptides based on poly(l-arginine): In vitro antibacterial evaluation and molecular dynamic simulations”, Eur. J. Med. Chem., 2024, 268, 116224.
2. Knopf-Marques H., et al. « Multifunctional polymeric implant coatings based on gelatin, hyaluronic acid derivative and chain length-controlled poly(arginine)”, Mat. Sci. Engineer. C, 104, 109898, 2019.
3. Mutschler A., et al. « Nature of the polyanion governs the antimicrobial properties of poly(arginine)/polyanion multilayer films », Chem. Mater., 2017, 29, 3195.
4. Patent EP3962543B1 “Polypeptide and hyaluronic acid coatings”, Lavalle P., Calligaro C., Gribova V., Tallet L., Vrana E.
5. Muller C. et al. “Localized Enzyme-Assisted Self-Assembly of low molecular weight hydrogelators. Mechanism, applications and perspectives“, Adv. Coll. Int. Sci, 2022, 102660.

THESIS OFFER : COMPACT PROTEIN-BASED MATERIALS AS TOUGH HYDROGELS FOR CARTILAGE AND TENDON REPAIR
DIRECTEUR DE THESE : ANDREAS REISCH
INSERM / CNRS / UNIVERSITE DE STRASBOURG, UMR _S 1121 – EMR CNRS 7003, BIOMATERIAUX ET BIOINGENIERIE, CRBS 1 RUE BOECKEL, 67000 STRASBOURG
TEL : 03 68 85 42 66
E-MAIL : reisch@unistra.fr
Hydrogels have proven to be valuable biomaterials for repair, regeneration and engineering of soft biological tissues. However, classical hydrogels are quite soft and fragile materials that fail in mimicking stiff yet elastic tissues like cartilage and tendon, stimulating an increasing interest in so-called tough hydrogels.1 Ideally, such biomaterials should, at first, close the defect and assure the cohesion of adjacent tissues, while limiting adverse reactions, and then, in the longer run, help in the repair of the tissue and the (re)establishment of normal functionality.2 Mechanical and adhesive properties therefore need to be combined with the presence of biological clues and controlled degradation.
Our lab has recently discovered a new approach to obtain mechanical resistant biomaterials composed only of albumin, through simple drying of protein solutions in the presence of certain salts, without any chemical crosslinking.3 The objective of the present PhD thesis will therefore be to extend this approach to the development of protein based tough hydrogel materials with mechanical properties close to those of cartilage and tendon, suitable for tissue-engineering applications.
In a first step, the formation of albumin based materials will be monitored using fluorescence microscopy and Förster resonance energy transfer (FRET), IR spectroscopy, and mechanical tests. Modification of the surface chemistry of albumin will be used to link properties of constituents, assembly conditions and final properties. The results will be the basis to extend the approach to the incorporation of increasing concentrations of (i) other soluble proteins and peptides, notably fibrinogen, elastin like peptides, charged peptides and resilin. (ii) Different types of other biomacromolecules, notably charged polyscaccharides will be integrated. And (iii) fibrous proteins, notably collagens, will be included. In this way the spectrum of biochemical composition and mechanical properties will be largely extended, and elastic modulus and toughness will be increased. The obtained materials will then be evaluated with respect to their interaction and colonization with cells and their biodegradation profile.
The PhD project will result in a new family of all natural tough biomaterials produced in low-energy, waterborne processes with potential applications as structural biomaterials for cartilage and tendon repair and engineering.
This work will be performed at the Biomaterials and Bioengineering lab (https://www.biomaterials-bioengineering.com) in close collaboration with clinicians and the start-up Albupad .
1. Petelinšek, N.; Mommer, S. Tough Hydrogels for Load-Bearing Applications. Adv. Sci. 2024, 11 (12), 2307404. https://doi.org/10.1002/advs.202307404.
2. Ullah, S.; Chen, X. Fabrication, Applications and Challenges of Natural Biomaterials in Tissue Engineering. Appl. Mater. Today 2020, 20, 100656. https://doi.org/10.1016/j.apmt.2020.100656.
3. Aloui, E.; De Giorgi, M.; Frisch, B.; Lavalle, P.; Schaaf, P. Protein Based Biomaterial with Viscoelastic Properties. EP 3811982 A1

THESIS OFFER: BIOLOGICAL AND CHEMICAL APPLICATIONS OF ELECTROPOLYMERIZED MATERIALS MADE FROM A MUSHROOM POLYPHENOL
DIRECTEUR DE THESE : VINCENT BALL
UMR _S 1121 – EMR CNRS 7003 -BIOMATERIAUX ET BIOINGENIEURE
TEL: 03 88 14 70 62
E-MAIL: VBALL@UNISTRA.FR
The electrodeposition of films from polyphenol containing solutions allows to produce functional and homogenous coatings on conductive materials from natural molecules known to display a broad range of biological properties (1,2). In a previous PhD work performed at the INSERM 1121 Unit in Strasbourg, it has been shown that thick (up to 400 nm) and highly swollen films can be deposited on carbon and gold working electrodes from aqueous solutions of 1,8-dihydroxynaphtalene (1,8-DHN), a natural polyphenol from mushrooms. Those films display antioxidant activities and are antibacterial against several strains of Pseudomonas Aeroginuosa and can be transfered on polydimethylsiloxane sheets.
It is the aim of the proposed PhD work to enlarge the applications of the 1,8-DHN based films and to investigate their structure. In particular their biocompatibility, the possibility to use them as biosensors and their electrical conductivity (without or with the incorporation of few layer graphene during the electrodeposition) will be investigated. Finally the electrocatalytic properties of the 1,8-DHN films incorporating metalic nanoparticles will also be studied.
1. Ball, V. (2017) Electrodeposition of pyrocatechol based films: influence of potential scan rate, pyrocatechol concentration and pH. Colloids and Surfaces A: Physicochem. & Eng. Aspects. 518, 109-115.
2. Ortiz-Pena, N, Ihiawakrim, D.; Ball, V.; Stanescu, S.; Rastei, M.; Sanchez, C.; Portehault, D.; Ersen. (2020) Correlative microscopy insight on electrodeposited ultrathin graphite oxide films. J. Phys. Chem. Lett. 11, 9117-9122.